来源:生物谷原创 | 2022-11-24 09:38:12 |
图片来源:摄图网
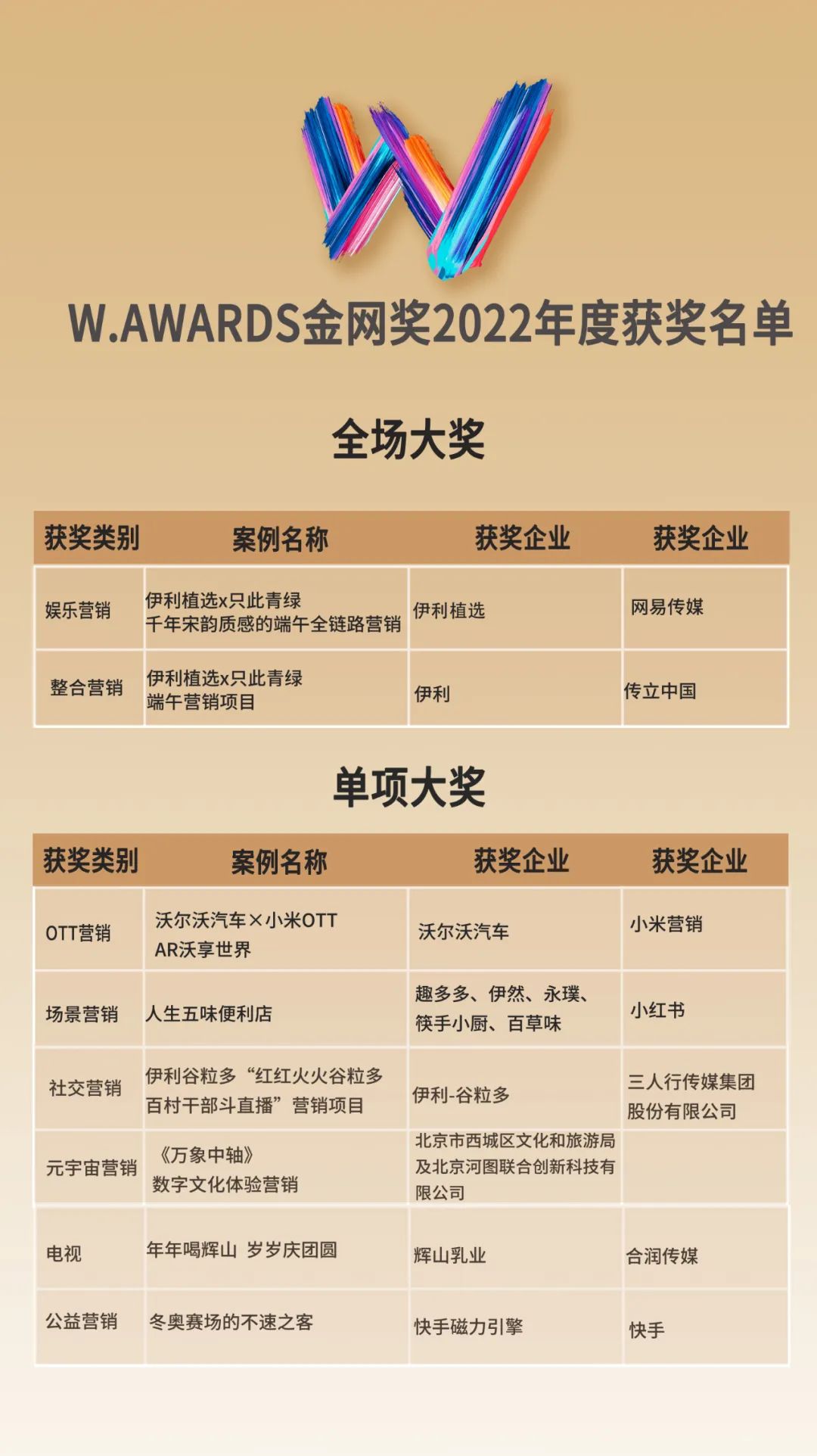
2022年11月18日讯 /生物谷BIOON/ --赛诺菲(Sanofi)近日宣布,欧盟委员会(EC)已批准Enjaymo(sutimlimab):用于冷凝集素病(CAD)成人患者,治疗溶血性贫血。2022年2月,Enjaymo已获得美国FDA批准:用于治疗CAD成人患者,减少因溶血导致的红细胞输注需求。2022年6月,Enjaymo也获得了日本厚生劳动省(MHLW)的批准。据估计,CAD影响美国、欧洲、日本约12000人,该病与严重疲劳、血栓栓塞事件和死亡的风险增加相关。
值得一提的是,Enjaymo是第一个也是唯一一个被批准用于治疗CAD的药物,通过抑制红细胞破坏(溶血)发挥作用。CAD是一种罕见、严重、慢性、自身免疫性溶血性贫血疾病,在这种疾病中,免疫系统中的补体系统错误地攻击人体健康红细胞并导致红细胞破裂(溶血)。CAD患者可能会经历慢性贫血、严重疲劳、急性溶血危象和其他潜在的并发症,包括血栓栓塞事件和早期死亡的风险升高。
 (资料图片仅供参考)
(资料图片仅供参考)
Enjaymo的活性药物成分为sutimlimab,这是一种首创的(first-in-class)人源化单克隆抗体,经专门设计用于选择性靶向和抑制C1复合物中的丝氨酸蛋白酶C1s,C1复合物是激活免疫系统经典补体途径的第一步。经典补体途径是先天免疫系统的一部分,其激活是CAD溶血的中心机制。通过靶向抑制C1s,sutimlimab据认为可阻断经典补体途径的激活,从而阻止CAD中的C1激活溶血的发生。
赛诺菲首席医疗官、全球研发总监Dietmar Berger表示:“这一批准凸显了我们开发首创(first-in-class)和同类最佳(best-in-class)疗法以改变患者生活的雄心。到目前为止,欧洲的患者不得不依靠避寒、输血、标签外治疗的组合策略来控制他们的疾病。欧盟委员会对Enjaymo的批准,首次为患者带来了一种可对CAD患者的治疗和日常生活体验产生有意义影响的治疗方法。”
冷凝集素病-CAD(图片来源:epainassist.com)
sutimlimab通过选择性抑制补体C1s来靶向CAD溶血的根本病因。sutimlimab具有新颖的作用机制和高度的靶点特异性,可选择性地抑制疾病过程中经典补体途径的上游,同时保留完整的替代补体途径和凝集素补体途径及其免疫监视功能。此前,美国FDA已授予sutimlimab突破性药物资格(BTD)和孤儿药资格(ODD)。欧盟EMA已授予sutimlimab孤儿药资格(ODD)。
此次批准,基于2项3期临床研究(CADENZA,CARDINAL)的数据。CADENZA是一项双盲安慰剂对照临床研究,在近期没有输血史(过去6个月内)的CAD患者中开展;CARDINAL是一项26周开放标签、单臂关键研究,在近期有输血史的CAD患者中开展。
2项研究均达到了主要终点和次要终点,Enjaymo治疗一周内就显示出持续抑制经典补体途径介导的溶血(C1激活的溶血,健康红细胞的异常破坏)、改善贫血、减轻疲劳,并在整个研究过程中具有持续的治疗效果。通过功能测定,经典补体途径的活性被迅速抑制,血红蛋白水平升高、胆红素水平降低和疲劳减轻与经典补体途径的抑制相一致。
sutimlimab-作用机制
在CADENZA研究A部分中,符合资格的患者以1:1随机分配,在第0天、第7天、然后每隔一周通过静脉输注基于体重的固定剂量(6.5g或7.5g)Enjaymo或安慰剂,直到第26周。该研究的开放标签B部分,评估了Enjaymo在CAD患者中的长期安全性和应答持久性。
在CADENZA研究A部分中,Enjaymo达到了主要复合终点和全部次要终点,证明了溶血抑制、血红蛋白水平增加以及慢性疾病治疗功能评估(FACIT)-疲劳评分有临床意义的改善。Enjaymo表现出可接受的安全性,总体耐受性良好。Enjaymo组96%的患者、安慰剂组100%的患者经历了至少一次治疗期不良事件(TEAE)。Enjaymo治疗组与安慰剂组相比,发生频率更高的不良事件包括头痛(22.7% vs 10.0%)、高血压(22.7% vs 0%)、鼻炎(18.2% vs 0%)、雷诺现象(18.2% vs 0%)和肢端发绀(13.6% vs 0%)。
在CARDINAL研究A部分中,患者在第0天、第7天、然后每隔一周通过静脉输注基于体重的固定剂量(6.5g或7.5g)Enjaymo或安慰剂,直到第26周。该研究的B部分评估了2年随访期间,Enjaymo在CAD患者中的长期安全性和应答持久性。
在CARDINAL研究A部分中,Enjaymo达到主要复合终点(血红蛋白[Hb]水平相对基线增加≥2g/dL或达到≥12g/dL、第5-26周期间无输血且不使用其他其他CAD相关治疗)和多个不同的次要终点(包括Hb改善、胆红素正常化、慢性病治疗功能评估[FACIT]疲劳评分的改善)。
发生在≥10%患者中的最常见不良反应包括呼吸道感染、病毒感染、腹泻、消化不良、咳嗽、关节痛、关节炎和周围水肿。在接受Enjaymo治疗的患者中,有13%(3/24)的患者报告了严重的不良反应。这些严重的不良反应包括链球菌败血症和葡萄球菌伤口感染(n=1)、关节痛(n=2)和呼吸道感染(n=3)。(生物谷Bioon.com)
原文出处:European Commission approves Enjaymo® (sutimlimab) for treatment of hemolytic anemia in adult patients with cold agglutinin disease

2022-11-24 09:46:39

2022-11-24 08:30:36

2022-11-24 08:44:28

2022-11-24 08:31:28

2022-11-24 08:29:47

2022-11-23 15:55:24

2022-11-23 15:54:24

2022-11-23 15:49:47

2022-11-23 15:49:12

2022-11-23 15:47:30

2022-11-23 15:46:40

2022-11-23 15:44:41

2022-11-23 15:43:58

2022-11-23 15:42:41

2022-11-23 15:42:15

2022-11-23 15:40:39

2022-11-23 15:39:18

2022-11-23 15:39:16

2022-11-23 15:37:45

2022-11-23 15:36:59

2022-11-23 15:35:56

2022-11-23 15:35:38

2022-11-23 15:34:10

2022-11-23 15:33:55

2022-11-23 15:31:34

2022-11-23 15:29:31

2022-11-23 15:28:38

2022-11-23 15:27:43

2022-11-23 15:03:08

2022-11-23 11:47:37

2022-11-23 11:37:10

2022-11-23 11:21:59

2022-11-23 11:11:32
2022-11-23 11:10:20

2022-11-23 11:05:08

2022-11-23 10:59:57

2022-11-23 10:17:40

2022-11-23 10:10:22

2022-11-23 10:08:39

2022-11-23 10:03:37

2022-11-23 10:01:30

2022-11-23 09:51:24

2022-11-23 09:48:21

2022-11-23 09:47:54

2022-11-23 09:46:30

2022-11-23 09:46:26

2022-11-23 09:46:10

2022-11-23 09:46:01

2022-11-23 09:44:53

2022-11-23 09:44:08

2022-11-23 09:44:06

2022-11-23 09:39:38

2022-11-23 09:38:29

2022-11-23 09:38:01

2022-11-23 09:33:31

2022-11-23 09:33:13

2022-11-23 09:30:07

2022-11-23 09:27:19

2022-11-23 09:26:04

2022-11-23 09:22:30

2022-11-23 09:16:33

2022-11-23 09:10:50

2022-11-23 08:51:26

2022-11-23 08:48:38

2022-11-23 08:48:07

2022-11-23 08:47:58

2022-11-23 08:47:56

2022-11-23 08:37:46

2022-11-23 08:34:33

2022-11-23 08:34:13

2022-11-23 08:33:45

2022-11-23 08:31:08

2022-11-23 08:28:49

2022-11-23 08:27:49

2022-11-23 08:23:29

2022-11-23 08:22:54

2022-11-23 08:18:37

2022-11-23 06:41:51

2022-11-23 05:45:17

2022-11-23 05:40:37

2022-11-22 22:37:46

2022-11-22 22:33:43

2022-11-22 22:30:41

2022-11-22 22:27:55

2022-11-22 21:38:05

2022-11-22 20:29:59


2022-11-22 20:27:39

2022-11-22 20:26:16

2022-11-22 19:43:02

2022-11-22 19:33:17

2022-11-22 18:59:18

2022-11-22 18:43:09

2022-11-22 18:39:29

2022-11-22 18:37:09

2022-11-22 18:36:38

2022-11-22 17:45:29

2022-11-22 17:23:33

2022-11-22 16:49:39

2022-11-22 16:49:35

2022-11-22 16:48:06

2022-11-22 16:47:33

2022-11-22 16:44:18

2022-11-22 16:43:18

2022-11-22 16:42:09
