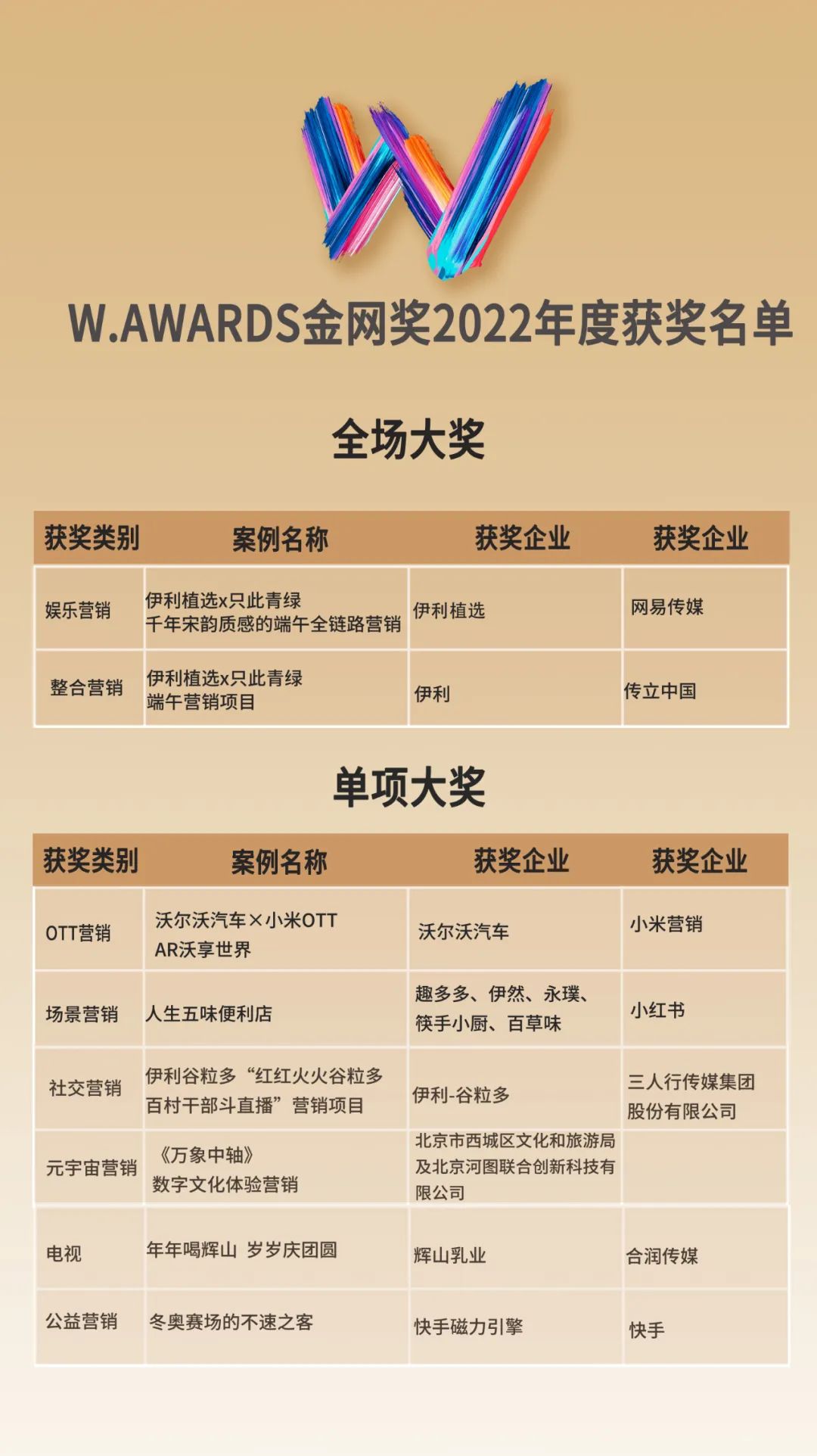
来源:生物谷原创 | 2022-11-24 09:43:11 |
图片来源:摄图网
2022年11月18日讯 /生物谷BIOON/ --Apellis制药公司近日宣布,美国食品和药物管理局(FDA)已受理该公司主动提出的对C3补体抑制剂Empaveli(pegcetacoplan,玻璃体腔注射)治疗年龄相关性黄斑变性(AMD)继发性地图样萎缩(GA)新药申请(NDA)的重大修订。更新后的《处方药付费者申报法案》(PDUFA)目标日期为2023年2月26日。FDA还重申,不打算召开咨询委员会会议讨论该申请。GA是一种不可逆的、毁灭性的疾病,会导致视力丧失。目前,尚无批准的治疗方法。
 (资料图片仅供参考)
(资料图片仅供参考)
2022年7月,FDA受理了Empaveli治疗GA的新药申请(NDA)并进行优先审查,该NDA基于3项大规模临床研究的结果(3期DERBY和OAKS研究的12个月和18个月数据,2期FILLY研究的12个月数据)。结果显示,在1500多名广泛的、异质性患者群体中,每隔一个月和每月一次Empaveli治疗均有意义地减少了GA病变生长、延缓了GA疾病的进展。3项研究中,Empaveli均显示出良好的安全性。
本月早些时候,Apellis宣布,公司决定提交3期DERBY和OAKS研究的24个月疗效数据,作为NDA审查的一部分。2项研究的24个月数据显示了每隔一个月和每月一次Empaveli增加且一致的疗效,同时安全性良好。Apellis仍有望在2022年底前向欧洲药品管理局(EMA)提交Empaveli的营销授权申请(MAA),其中也将纳入24个月结果。
GA是年龄相关黄斑变性(AMD)的一种晚期病变,可导致不可逆转的失明。GA是致盲的首要原因,该病影响全球500多万人、美国100万人。目前,GA还没有批准的治疗方法。GA是一种进行性疾病,GA病变侵犯中央凹(负责中央视力)平均需要2.5年,会严重损害视觉功能、独立性和生活质量。
GA是由补体过度激活导致的不可逆损伤生长破坏视网膜细胞引起的。由于处于补体级联的中心位置,C3是能够精确控制补体级联的唯一靶标。Empaveli是一种靶向性补体C3疗法,旨在通过调节补体级联的过度激活,控制疾病的发生发展。
C3处于补体级联的中心位置
Empaveli的活性药物成分pegcetacoplan是一种靶向性C3抑制剂,旨在调节补体过度激活,这是导致许多严重疾病发生和发展的原因。pegcetacoplan是一种合成的环肽,与一种聚乙二醇聚合物结合,特异性地与C3和C3b结合。目前,pegcetacoplan正被开发用于治疗多种疾病,包括PNH、GA和C3肾小球病。在美国,FDA已授予pegcetacoplan治疗PNH和GA的快速通道资格。
Empaveli是第一种获得监管批准的C3靶向疗法,该药已于2021年5月获得美国FDA批准、2022年12月获得欧盟委员会(EC)批准上市:用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。适用于:(1)先前没有接受过治疗的PNH成人患者;(2)先前接受过C5抑制剂Soliris(eculizumab)和Ultomiris(ravulizumab)的PNH成人患者。
在过去十多年来,治疗PNH的唯一选择是C5抑制剂,但许多患者仍然经历持续性低血红蛋白症,常常导致虚弱的疲劳和频繁的输血。在临床试验中,Empaveli能针对PNH提供广泛的控制,通过增加血红蛋白水平及减少输血需求来改善PNH患者的生活。(生物谷Bioon.com)
原文出处:Apellis Announces FDA Acceptance of NDA Amendment and New PDUFA Date of February 26, 2023 for Pegcetacoplan for Geographic Atrophy (GA)

2022-11-24 09:46:39

2022-11-24 08:30:36

2022-11-24 08:44:28

2022-11-24 08:31:28

2022-11-24 08:29:47

2022-11-23 15:49:47

2022-11-23 15:49:12

2022-11-23 15:47:30

2022-11-23 15:46:40

2022-11-23 15:44:41

2022-11-23 15:43:58

2022-11-23 15:42:41

2022-11-23 15:42:15

2022-11-23 15:40:39

2022-11-23 15:39:18

2022-11-23 15:39:16

2022-11-23 15:37:45

2022-11-23 15:36:59

2022-11-23 15:35:56

2022-11-23 15:35:38

2022-11-23 15:34:10

2022-11-23 15:33:55

2022-11-23 15:31:34

2022-11-23 15:29:31

2022-11-23 15:28:38

2022-11-23 15:27:43

2022-11-23 15:03:08

2022-11-23 11:47:37

2022-11-23 11:37:10

2022-11-23 11:21:59

2022-11-23 11:11:32
2022-11-23 11:10:20

2022-11-23 11:05:08

2022-11-23 10:59:57

2022-11-23 10:17:40

2022-11-23 10:10:22

2022-11-23 10:08:39

2022-11-23 10:03:37

2022-11-23 10:01:30

2022-11-23 09:51:24

2022-11-23 09:48:21

2022-11-23 09:47:54

2022-11-23 09:46:30

2022-11-23 09:46:26

2022-11-23 09:46:10

2022-11-23 09:46:01

2022-11-23 09:44:53

2022-11-23 09:44:08

2022-11-23 09:44:06

2022-11-23 09:39:38

2022-11-23 09:38:29

2022-11-23 09:38:01

2022-11-23 09:33:31

2022-11-23 09:33:13

2022-11-23 09:30:07

2022-11-23 09:27:19

2022-11-23 09:26:04

2022-11-23 09:22:30

2022-11-23 09:16:33

2022-11-23 09:10:50

2022-11-23 08:51:26

2022-11-23 08:48:38

2022-11-23 08:48:07

2022-11-23 08:47:58

2022-11-23 08:47:56

2022-11-23 08:37:46

2022-11-23 08:34:33

2022-11-23 08:34:13

2022-11-23 08:33:45

2022-11-23 08:31:08

2022-11-23 08:28:49

2022-11-23 08:27:49

2022-11-23 08:23:29

2022-11-23 08:22:54

2022-11-23 08:18:37

2022-11-23 06:41:51

2022-11-23 05:45:17

2022-11-23 05:40:37

2022-11-22 22:37:46

2022-11-22 22:33:43

2022-11-22 22:30:41

2022-11-22 22:27:55

2022-11-22 21:38:05

2022-11-22 20:29:59


2022-11-22 20:27:39

2022-11-22 20:26:16

2022-11-22 19:43:02

2022-11-22 19:33:17

2022-11-22 18:59:18

2022-11-22 18:43:09

2022-11-22 18:39:29

2022-11-22 18:37:09

2022-11-22 18:36:38

2022-11-22 17:45:29

2022-11-22 17:23:33

2022-11-22 16:49:39

2022-11-22 16:49:35

2022-11-22 16:48:06

2022-11-22 16:47:33

2022-11-22 16:44:18

2022-11-22 16:43:18

2022-11-22 16:42:09

2022-11-22 16:41:42

2022-11-22 16:39:01
