来源:生物世界 | 2022-05-17 09:05:41 |
2017年10月,FDA 批准了首款 CAR-T 细胞疗法上市,人类进入细胞治疗时代,CAR-T 细胞疗法在血液类癌症中取得了很好的临床效果。目前,已上市的几款 CAR-T 疗法都是使用的来自患者自身的自体 T 细胞,自体细胞疗法的优势在于能够在患者体内长时间发挥作用,且不产生排异反应,但该方法也存在着许多局限性,自体细胞疗法耗时长,一些急性白血病患者没有足够时间等待,此外,许多严重患者本身没有足够的 T 细胞用于工程化改造。因此,许多研究团队和公司开始致力于开发异体细胞疗法,异体细胞疗法的细胞来源更多样,可以是外周血、脐带血,以及人工诱导多能干细胞(iPSC)等等,该方法更容易批量生产,耗时更少,能够解决自体细胞疗法的多种局限。其中,诺奖得主、CRISPR 基因编辑技术奠基人之一的Jennifer Doudna创立的Caribou Biosciences便是其中的代表。2022年5月12日,Caribou Biosciences宣布,其开发的基于CRISPR 基因编辑的现货型 CAR-T 疗法CB-010,在治疗复发难治性B细胞非霍奇金淋巴瘤的1期临床试验中效果积极。这也是Caribou首次公布人体临床试验数据。公布的数据显示,可评估的5名患者中,总缓解率(ORR)达100%,完全缓解率(CR)达80%。截至目前,完全缓解的4名患者中,治疗后三个月仍然如此,最长的完全缓解记录为六个月。据悉,Caribou将在下个月举办的欧洲血液学协会(EHA)年会上进一步公布详细数据。CB-010疗法是一款基于 CRISPR 基因编辑的同种异体抗 CD19 CAR-T 细胞疗法。使用Caribou专有的chRDNA技术进行基因编辑,chRDNA,即 CRISPR 杂合 RNA-DNA 技术,相比于CRISPR-Cas9 ,chRDNA 具有高度特异性和更低的脱靶编辑水平,可实现多重基因编辑,包括多重基因插入。CB-010疗法进行了3个方面的基因编辑:1、将CD19CAR 位点特异性敲入 T 细胞;2、敲除TRAC基因(T细胞受体α恒定区),敲除后,T 细胞表面的 T 细胞受体(TCR)被清除,可避免移植物抗宿主反应(GvHD);3、敲除编码PD-1的基因,提高 CAR-T 细胞抗肿瘤活性的持久性。据悉,这也是首个临床研究中的敲除 PD-1 的同种异体 CAR-T 细胞疗法。Caribou Biosciences的 CEORachel Haurwitz表示,目前已经获得 FDA 批准上市的3款 CD19 -CAR-T细胞疗法(吉利德的Yescarta、BMS 的 Breyanzi、诺华的 Kymriah),总缓解率在50%-70%,完全缓解率在30%-50%。而 CB-101的这两项数据分别是100%和80%。此外,CB-101还有一个优势,就是给药剂量远低于上述三款 CAR-T 细胞疗法,这可能会更安全。Rachel Haurwitz表示,CB-101 治疗后没有出现移植物抗宿主反应(GvHD),观察到的大多数不良事件是1级或2级,在治疗的前28天内,在6名患者中的3名中观察到了更严重的3级和4级事件,但他们在接受治疗39小时内恢复,总体来说,CB-101耐受性良好。基于这些初步临床数据,Caribou 计划进入剂量递增阶段,此次的6名患者输注的是4000万个 CAR-T 细胞,下一个队列将进行 8000万个 CAR-T 细胞的输注。

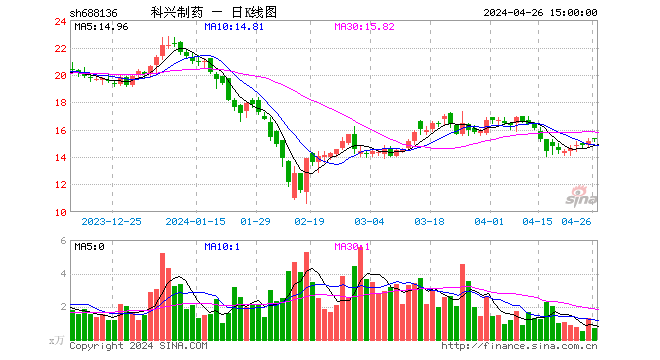
2022-05-13 16:59:22

2022-05-13 16:54:40

2022-05-13 16:51:26

2022-05-13 16:45:14

2022-05-13 16:32:09
2022-05-14 05:48:51
2022-05-14 05:46:22
2022-05-14 05:43:14
2022-05-14 05:42:11
2022-05-14 05:27:24
2022-05-14 05:24:39
2022-05-14 05:24:13
2022-05-14 05:18:00
2022-05-14 05:16:33
2022-05-14 05:16:12
2022-05-14 04:59:57

2022-05-13 16:59:22

2022-05-13 16:54:40

2022-05-13 16:51:26

2022-05-13 16:45:14

2022-05-13 16:37:13

2022-05-13 16:32:09

2022-05-13 16:25:37

2022-05-13 16:16:39

2022-05-13 14:24:34

2022-05-13 09:44:41

2022-05-13 09:38:11

2022-05-13 09:31:09

2022-05-13 09:27:38

2022-05-13 09:20:49

2022-05-13 09:17:40

2022-05-13 09:15:21

2022-05-13 08:54:52

2022-05-13 08:47:07

2022-05-13 08:43:22

2022-05-13 08:38:53

2022-05-13 08:36:24

2022-05-13 08:32:27

2022-05-13 08:29:27

2022-05-13 08:24:14

2022-05-13 08:21:50

2022-05-13 08:14:13

2022-05-13 08:13:37
2022-05-12 21:30:23

2022-05-12 17:07:08

2022-05-12 16:57:05

2022-05-12 16:49:47

2022-05-12 16:46:07
2022-05-12 16:43:06

2022-05-12 16:39:20

2022-05-12 16:36:30

2022-05-12 16:32:18

2022-05-12 16:29:10

2022-05-12 16:25:50

2022-05-12 16:15:18

2022-05-12 16:10:41
2022-05-12 14:14:57

2022-05-12 10:55:41

2022-05-12 09:33:42

2022-05-12 09:27:24

2022-05-12 09:23:38

2022-05-12 09:18:04

2022-05-12 09:12:45

2022-05-12 09:09:35

2022-05-12 08:47:23

2022-05-12 08:45:10

2022-05-12 08:41:54

2022-05-12 08:38:57
2022-05-12 08:36:52

2022-05-12 08:32:05

2022-05-12 08:29:40

2022-05-12 08:25:56

2022-05-12 08:22:21

2022-05-12 08:20:08

2022-05-12 08:15:51

2022-05-12 08:12:02
2022-05-11 18:21:02

2022-05-11 17:24:55

2022-05-11 17:22:26

2022-05-11 17:19:47

2022-05-11 17:17:18

2022-05-11 17:15:04

2022-05-11 16:46:29

2022-05-11 16:41:51

2022-05-11 16:37:56

2022-05-11 16:32:05

2022-05-11 16:28:39

2022-05-11 16:25:41

2022-05-11 16:22:26

2022-05-11 16:19:08

2022-05-11 16:15:02

2022-05-11 16:10:57

2022-05-11 15:49:36

2022-05-11 15:04:02

2022-05-11 14:41:29

2022-05-11 14:39:57

2022-05-11 14:02:32

2022-05-11 13:23:47

2022-05-11 10:20:38

2022-05-11 09:20:10

2022-05-11 09:05:43

2022-05-11 09:01:57

2022-05-11 08:58:37

2022-05-11 08:54:40

2022-05-11 08:52:08
